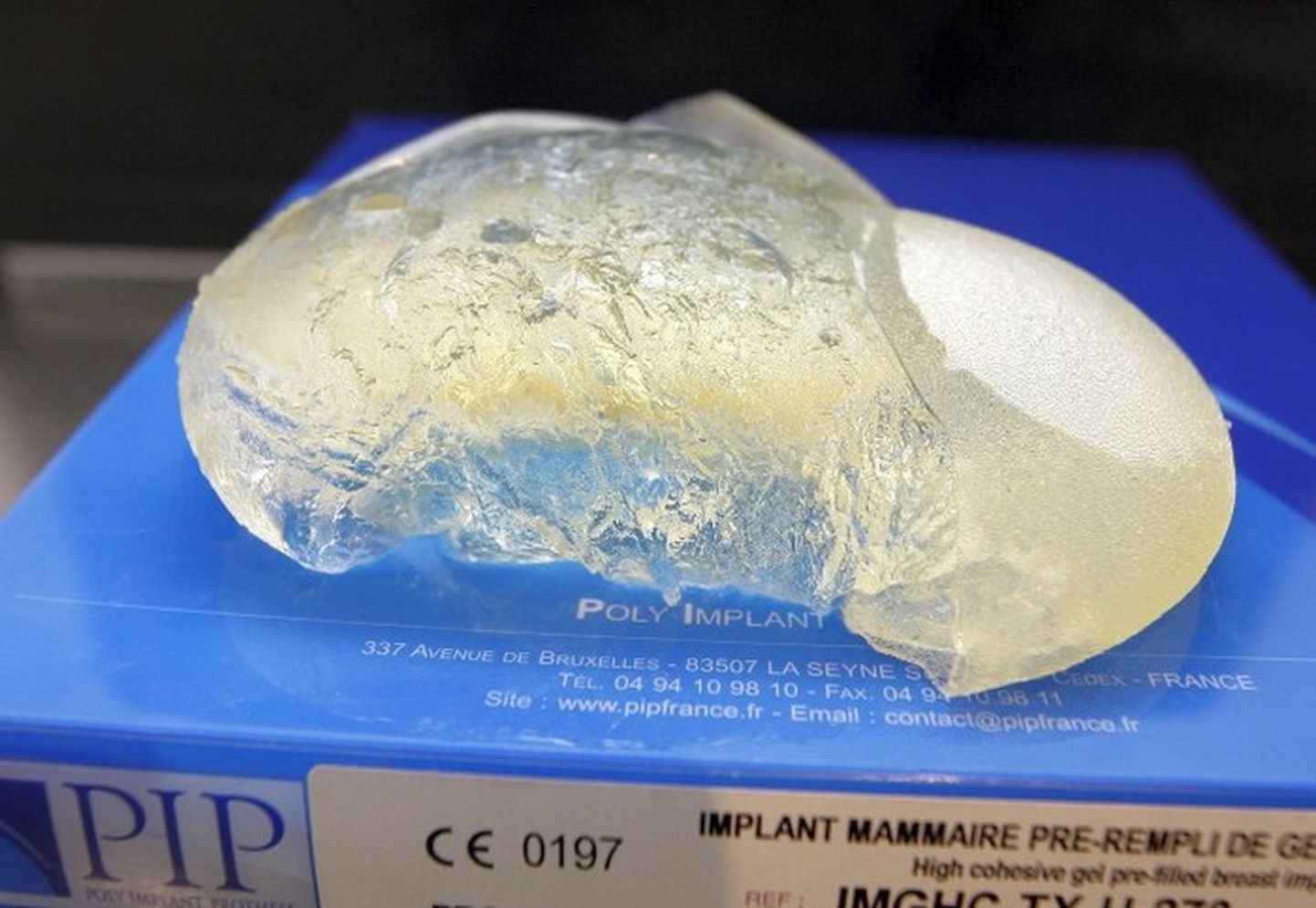
Uzņēmums PIP Eiropā un pasaulē izplatījis ap 400 000 krūšu implantu, īpaši Lielbritānijā, Francijā, Spānijā un Vācijā. Par kuriem vēlāk konstatēja, ka tajos izmantots nekvalitatīvs silikona gels un tiem ir paaugstināts plīšanas risks. Tomēr nav precīzi zināms, cik daudz sieviešu saņēmušas attiecīgos implantus.Rezolūcijā, ko Parlaments pieņēma ar balsu vairākumu, deputāti uzsver, ka PIP gadījums ir pievērsis «uzmanību Eiropas un valstu līmeņa trūkumiem, īpaši nepietiekamajai sadarbībai un arī neiespējamībai izsekot medicīnas ierīcēs izmantotajiem izejmateriāliem».
Deputāti prasa Komisijai pāriet uz sistēmu, saskaņā ar kuru konkrētām medicīnas ierīču kategorijām, tostarp krūšu implantiem, pirms laišanas tirgū ir jāsaņem atļauja. Deputāti aicina ieviest «implanta saņēmēja pasi», tajā norādot implanta specifiskās īpašības un potenciālo nelabvēlīgo ietekmi.
Parlaments rosina ikvienā dalībvalstī izveidot implantu reģistru, tomēr uzsver, ka pacienta personas datu iekļaušanai reģistrā būtu jānotiek ar personas piekrišanu. Valstu reģistriem jābūt savstarpēji savienotiem, nodrošinot iespēju vajadzības gadījumā apmainīties ar informāciju, piemēram, gadījumos, kad implantos atklāti būtiski trūkumi, norādīts tekstā.Tirgus uzraudzība
Deputāti arī aicina pastiprināt kontroli, tirgus uzraudzību un informēt pacientus par ierīču iespējamo bīstamību, kā arī veidot vienotu Eiropas datu bāzi, kurā apkopotu informāciju par tirgū pieejamajām medicīnas ierīcēm, reģistrētu uzņēmējdarbību, negadījumu un tirgus uzraudzības iniciatīvām, klīniskajiem pētījumiem, pilnvarotajām iestādēm un piešķirtajiem CE sertifikātiem.